|
|
Medicina popolareper autodidatti
agosto 6, 2005 |
|
Indice della pagina 1.0 Introduzione 1.1 Meccanismo
omeostatico biochimico 1.2 Concentrazione
ioni idrogeno (pH) 1.3 Regolazione pH
cellulare 1.4 Variazioni pH
cellulare 2.0 Controllo del
pH dei liquidi del corpo 2.1 Significato di
pH 2.2 Sorgenti degli
elementi che influenzano il'acidità 2.3 Alimenti
potenzialmente formanti acidi 2.4 Tipi di
meccanismi di controllo del pH 2.5 Efficacia dei
meccanismi di controllo del pH 3.0 Meccanismo
tampone 3.1 Definizione di
tampone 3.2 Coppie tampone
presenti nei liquidi del corpo 3.3 Azione dei
tamponi 3.4 Valutazione del
ruolo dei tamponi 4.0 Meccanismo
respiratorio 4.1 Aggiustamento
del respiro 4.2 Spiegazione del
meccanismo 5.0 Meccanismo
urinario 5.1 Principi
generali sul meccanismo 5.2 Meccanismi
che controllano il pH dell¹urina |
AF 5.29 Omeostasi
acido-alcalino
© Peter Forster Bianca Buser Secondo Thibodeau & Patton Pagine correlate: MmP 16.1
|
1.0 Introduzione
Sono trattati i seguenti argomenti:
- Meccanismo
omeostatico biochimico.
- Concentrazione
ioni idrogeno (pH).
- Regolazione
pH cellulare.
- Variazioni
pH cellulare.
1.1 Meccanismo
omeostatico biochimico
L¹equilibrio acido-base è uno dei più importanti tra
i meccanismi omeostatici del corpo.
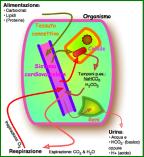
1.2 Concentrazione
ioni idrogeno (pH)
L¹equilibrio acido-base è la regolazione della
concentrazione degli ioni idrogeno nei liquidi del corpo.
1.3 Regolazione
pH cellulare
Per assicurare la sopravvivenza è necessaria una
precisa regolazione del pH a livello cellulare.
1.4 Variazioni
pH cellulare
Oscillazioni anche modeste del pH hanno effetti
drammatici sul metabolismo cellulare.
2.0 Meccanismi
che controllano il pH dei liquidi del corpo
Sono trattati i seguenti argomenti:
- Significato
di pH.
- Sorgenti
degli elementi che influenzano il pH (acidità).
- Alimenti
potenzialmente formanti acidi.
- Tipi di
meccanismi di controllo del pH.
- Efficacia
dei meccanismi di controllo del pH.
2.1 Significato
di pH
Logaritmo negativo della concentrazione degli ioni
idrogeno in una soluzione (fig. 29-1)
7 ‹> neutro; 7Š ‹> basico, alcalino; Š7 ‹>
acido.
2.2 Sorgenti
degli elementi che influenzano il pH (acidità)
- Acido
carbonico - formatosi dal metabolismo aerobico del glucosio H2CO3.
- Acido
lattico - formatosi dal metabolismo anaerobico del glucosio CH3-CH(OH)-COOH.
- Acido
solforico - formatosi per l¹ossidazione di aminoacidi contenenti zolfo H2SO4.
- Acido
fosforico - formatosi in seguito alla degradazione di fosfoproteine,
nucleoproteine e fosfati ossei e lipidi H3PO4.
- Corpi
chetonici acidi - formatisi per la degradazione di grassi
- Acetone.
- Acido
acetacetico.
- Acido
Beta-idrossibutirrico.
2.3 Alimenti
potenzialmente formanti acidi
Determinati dal contenuto in cloro, zolfo, fosforo.
2.4 Tipi
di meccanismi di controllo del pH
Chimico - tamponi a rapida azione.
- Sistema
tampone bicarbonato.
- Sistema
tampone fosfato.
- Sistema
tampone delle proteine.
Fisiologici - tamponi ad azione ritardata.
- Risposta
respiratoria.
- Risposta
renale.
Sommario sui meccanismi di controllo del pH.
- Tamponi
chimici.
- Respiro.
- Escrezione
renale di acidi e basi.
2.5 Efficacia
dei meccanismi di controllo del pH
Intervallo dei valori del pH ematico: I
relativi meccanismi sono estremamente efficaci, mantengono di norma il pH
ematico entro un intervallo di varibilità molto stretto da 7.36 a 7.41
(leggermente alcalinico).
3.0 Meccanismo
tampone per il controllo del pH dei liquidi del corpo
Sono trattati i seguenti argomenti:
- Definizione
di tampone.
- Coppie
tampone presenti nei liquidi del corpo.
- Azione
dei tamponi.
- Valutazione
del ruolo dei tamponi nel controllo del pH.
3.1 Definizione
di tampone
Sostanze atte a prevenire marcate
modificazioni del pH di una soluzione quando si aggiungono a questa acidi o
basi. Consistono di un acido debole (o del suo sale acido) e del sale basico di
quell¹acido.
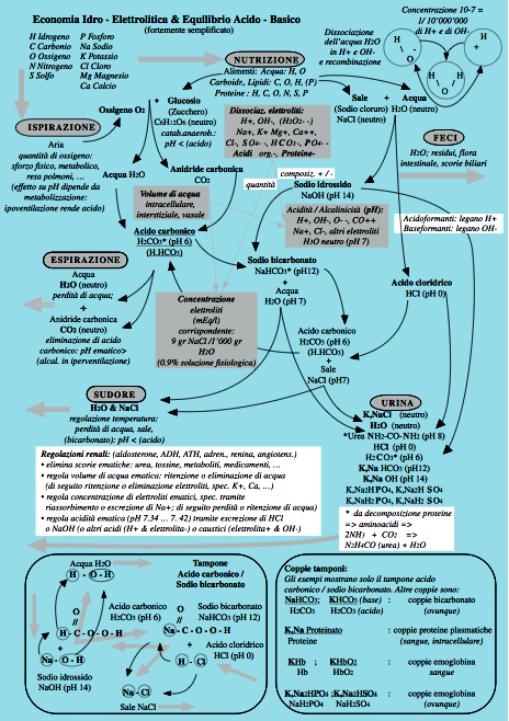
3.2 Coppie
tampone presenti nei liquidi del corpo
Principalmente:
- Acido
carbonico, proteine, emoglobina, acido fosforico.
- Sali
di sodio e di potassio di questi acidi deboli.
3.3 Azione
dei tamponi
(fig. 29-4) (fig. 29-5)
Prevengono marcate modificazioni del pH dei liquidi
del corpo:
Acidi non volatili, come acido cloridrico, acido
lattico, corpi chetonici, vengono tamponati principalmente dal sodio
bicarbonato.
Acidi volatili - soprattutto acido carbonico, vengono
tamponati principalmente dai sali di potassio dell¹emoglobina e
dall¹ossiemoglobina.
Lo scambio del cloro consente all¹acido carbonico di
essere tamponato all¹interno dei globuli rossi e trasportato poi nel plasma
come bicarbonato.
Basi tamponate principalmente da acido carbonico
(quando esiste l¹omeostasi del pH a 7.4).
B*.HCO3 20
Rapporto ‹‹‹‹ = ‹‹
H2CO3 1
B*: ione singolarmente positivo come sodio o
potassio
L¹equazione di Henderson-Hasselbach è
un¹espressione matematica che spiega le correlazioni tra la concentrazione
degli ioni idrogeno nei liquidi del corpo e il rapporto tra base bicarbonato e
acido carbonico.
3.4 Valutazione
del ruolo dei tamponi nel controllo del pH
È impossibile mantenere il pH entro valori di norma
senza adeguato funzionamento (a lungo termine) dei meccanismi respiratorio e
urinario di controllo del pH.
4.0 Meccanismo
respiratorio di controllo del pH
Sono trattati i seguenti argomenti:
- Aggiustamento
del respiro.
- Spiegazione
del meccanismo.
- Alcuni principi per correlare gli
atti respiratori del pH dei liquidi del corpo.
4.1 Aggiustamento
del respiro
Frequenza e profondità di respiro vengono adattate al
pH del sangue arterioso.
4.2 Spiegazione
del meccanismo
La quantità di anidride carbonica CO2 del sangue è
direttamente correlata alla quantità di acido carbonico H2CO3 e quindi alla
concentrazione di H+.
Con l¹aumento degli atti respiratori resta meno
anidride carbonica nel sangue, quindi meno acido carbonico e H+; con la
diminuzione degli atti respiratori resta più anidride carbonica nel sangue,
quindi più acido carbonico e più H+.
4.2.1 Alcuni
principi per correlare gli atti respiratori del pH dei liquidi del corpo
Alcalosi iperventilazione
aumenta
l¹eliminazione di CO2
diminuisce
la CO2 del sangue
diminuisce
l¹H2CO3 del sangue
diminuisce
l¹H+ del sangue, cioè, aumenta il pH del sangue (verso alcalinicità)
tende
a correggere l¹alcalosi e, quindi, a restaurare il pH
L¹iperventilazione prolungata, diminuendo
eccessivamente l¹H+ del sangue, può produrre alcalosi con spasmi e alterati
stati di coscienza.
L¹acidosi causa ipoventilazione che tende a
correggere l¹acidosi aumentando la CO2 del sangue e quindi l¹H2CO3 e gli H+.
L¹ipoventilazione prolungata, eliminando pochissima
anidride carbonica provoca aumento dell¹H2CO3 del sangue, conseguentemente
anche degli H+ del sangue e produce acidosi.
5.0 Meccanismo
urinario per il controllo del pH
Sono trattati i seguenti argomenti:
- Principi
generali sul meccanismo.
- Meccanismi
che controllano il pH dell¹urina.
5.1 Principi
generali sul meccanismo
Gioca un ruolo vitale nel meccanismo dell¹equilibrio
acido-base perché i reni possono eliminare più H+ dal corpo, mentre riassorbono
più basi quando il pH tende verso l¹acidità ed eliminano meno H+ riassorbendo
meno basi quando il pH tende all¹alcalinità.
5.2 Meccanismi
che controllano il pH dell¹urina
Secrezione di H+ nell¹urina - quando la CO2 del
sangue, l¹H2CO3 e l¹H+ aumentano oltre la norma, i tubuli distali secernono più
H+ nell¹urina, scambiando questo ione con gli ioni basici (principalmente
sodio) che tornano dall¹urina nel sangue aumentando (o mantenendo) gli
elettroliti alti e la tendenza alla ritenzione di acqua.
Secrezione di NH3 (ammoniaca) - quando aumenta la
concentrazione degli ioni idrogeno, i tubuli distali secernono più NH3 che si
combina con gli H+ dell¹urina per formare ioni ammonio. Questi ioni spostano
ioni basici (principalmente sodio) di un sale che vengono riassorbiti nel
sangue in cambio degli ioni ammonio che vengono escreti. I sali tornano
dall¹urina nel sangue aumentando (o mantenendo) gli elettroliti alti e la
tendenza a ritenzione di acqua.
|
|
|||||||
|
|
|
||||||
|
|
|||||||
|
© 2005 P. Forster & B. Buser via Tesserete,
CH-6953 Lugaggia, Switzerland Everyone is permitted to copy
and distribute verbatim copies of this license document, but changing it is
not allowed. GFDL Gnu Free Documentation
License Il materiale contenuto in questo sito può essere
usato secondo le leggi Statunitensi sul (non per scopi di lucro; citazione della fonte). |