Basi chimiche della vita
per Terapisti complementari
| Autrice: Nathalie Steib, Bianca Buser | Dispensa: Dr. med. Adriano Sassi, CH-6944 Cureglia |
| Illustrazioni, links: P.Forster | Categoria: CSA, Anatomia, Fisiologia, Biochimica |
On this page... (hide) |  Metabolismo energetico (catabolismo) |
1. La struttura della materia
Per poter meglio capire i concetti che verranno esposti in seguito, sarř utile avere qualche nozione sulla struttura della materia e della chimica. La materia ╦ composta di molecole:
- Molecola
: - ╚ la piś piccola parte di materia che conservi le proprie caratteristiche chimiche (ad es. acqua, gesso, alcol, glucosio,...). I tipi di molecole in natura sono praticamente infiniti. Esse sono composte da atomi legati fra loro in modi e in numero variabilissimo.
- Atomo
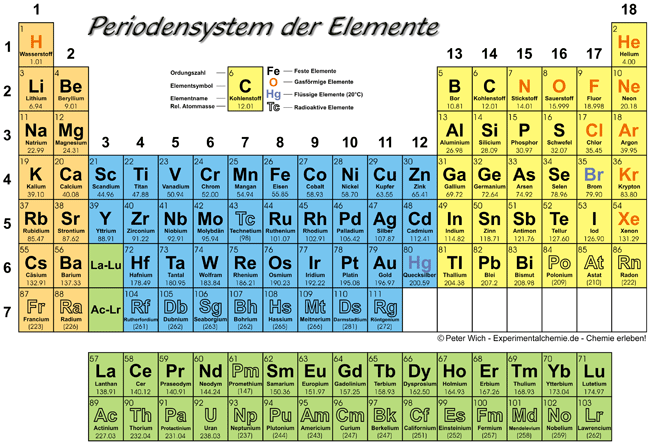
: - ╦ la piś piccola parte di un elemento chimico che conservi le proprie caratteristiche. Gli elementi in natura sono 90 (il tecnezio e il promezio sono elementi artificiali). Nella tabella degli elementi si possono dedurre alcune caratteristiche chimiche degli stessi, perch╚ esse si ripetono periodicamente.
- Biochimica
: - branca della chimica che si occupa degli organismi viventi e dei processi vitali.
2. Terminologia, definizioni
- Molecola
: - ╦ la piś piccola parte della materia che conservi le proprie caratteristiche chimiche (es. acqua, glucosio etc.). E? composta da atomi legati fra loro in modo e numero variabilissimo. In natura il numero delle molecole ╦ infinito.
- Atomo
: - ╦ la piś piccola parte di un elemento chimico che conservi le propri caratteristiche. La particella piś piccola di un elemento che mantiene le proprietř dell?elemento.
- Particelle subatomiche
: - protone +, elettrone -, neutrone â.
- Elemento
: - il ?puro? elemento non pu┌ essere suddiviso o scomposto in due o piś sostanze (l?ossigeno puro ╦ un elemento).
- Composto
: - Combinazione chimica di due o piś elementi (uniti).
Esempio: Acqua H2O = 2 atomi di Idrogeno e un atomo di ossigeno.
- Sostanza
: - comprende o ╦ formata sia da elementi che composti.
- Legame ionico
: - legame elettrocovalente (elettrico); legane formato dal trasferimento (scambio) di elettroni da un atomo all?altro.
- Legame covalente
: - legame chimico formato da 2 atomi che condividono uno o piś elettroni(la tendenza degli elementi ad attirare gli elettroni condivisi nel legame covalente prende il nome di elettronegativitř).
- Sali
: - Sono generalmente composti ionici di un metallo con un non metallo (esempio Na+Cl-)
- Acidi
: - sono gli elettroliti che si ionizzano nell?acqua producendo ioni H+
- Basi
: - sono gli elettroliti che in acqua forniscono ioni OH-
- pH Concentrazione di ioni di idrogeno
: - Unitř di misura della basicitř (alcalinitř) e della aciditř delle sostanze (da 0 a 14). Per esempio l?acqua pura ha un pH 7 che indica un pH Neutro. Quando le sostanze hanno un pH inferiore a 7 esse sono acide (molti ioni H+ in soluzione), mentre quando sono superiori al ph 7 esse sono basiche (molti ioni OH-).
3. Struttura dell'atomo
L'atomo ╦ un sistema di particelle elettriche in cui attorno ad un nucleo composto da protoni (con carica positiva) e neutroni (neutri) ruota una nuvola di elettroni (carica negativa) nello stesso numero dei protoni. In questo modo l'atomo ╚ neutro. Essenziale per le caratteristiche chimiche dell'atomo ╚ lo strato piś esterno degli elettroni. Essi infatti possono "saltare" da un atomo all'altro o esser messi in comune da diversi atomi, in questo modo si creano le molecole dei diversi composti chimici.
A causa del diverso numero di elettroni sullo strato esterno le caratteristiche chimiche degli elementi variano. In base a questi essi vengono divise in tre grosse categorie:
- metalli,
- non metalli
- gas nobili.
3.1 Metalli
I metalli (sono la maggior parte degli elementi) sono elementi che tendono a perdere parte degli elettroni del loro strato esterno. Per questo sono in genere buoni conduttori di elettricitř. Fatta eccezione per il mercurio, che ╦ liquido, a temperatura ambiente sono tutti solidi. L'idrogeno, pur essendo gassoso, si comporta chimicamente piuttosto come il metallo, ma ╦ un caso del tutto particolare.
3.2 Non metalli
Essi sono elementi che tendono invece a prendere elettroni in piś sul loro strato esterno. Per questo sono cattivi conduttori elettrici (isolanti). Diversi sono gassosi, uno ╚ liquido (bromo) e la maggior parte sono solidi.
3.3 Gas nobili
sono solo sei, tutti gassosi, e sono inerti chimicamente, cio╦ non reagiscono con gli altri elementi, non entrano quindi mai a far parte di composti chimici.
3.4 Ioni
Quando un atomo perde (metalli) o acquista (non metalli) uno o piś elettroni si forma quello che si chiama uno ione. Uno ione pu┌ essere formato da uno o anche piś atomi legati fra loro, ed ╦ dotato di carica elettrica. In un certo senso ╦ un pezzo di molecola che ha perso il suo compagno. Le sostanze saline quando vengono sciolte in acqua formano ioni.
4. Legami
Un legame ionico ╦ appunto il legame (in questo caso elettrico) che esiste tra due ioni, uno positivo e uno negativo, di un composto salino. L'esempio piś classico ╦ quello del sale da cucina: Na+Cl-.
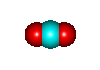
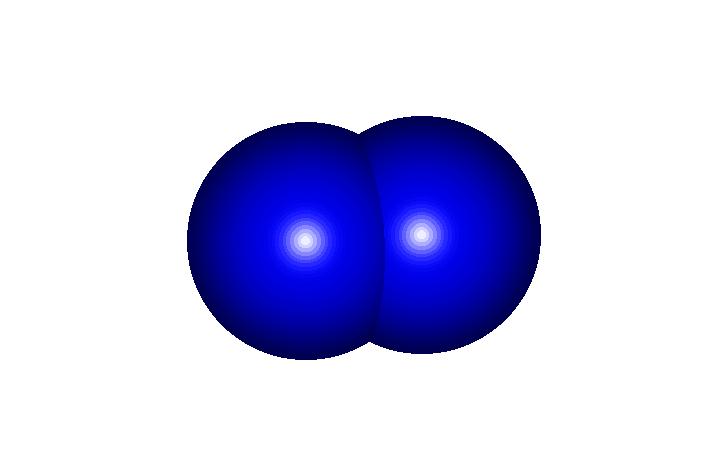
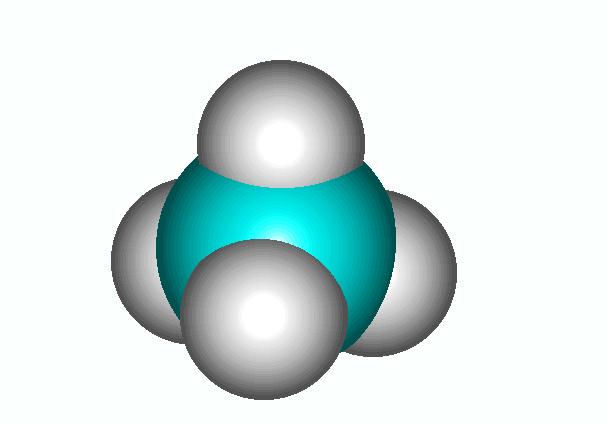
Quando invece gli elettroni vengono messi in comune tra due atomi si parla di legame covalente. In questo caso non si formano ioni e i differenti atomi rimangono sempre legati fra loro. E' il tipico legame che esiste fra non metalli ed in particolare nella chimica organica fra il carbonio e gli altri elementi. Per esempio: CO2, N2, CH4.
Fra i non metalli e l'idrogeno in particolare vi ╚ un legame nel quale l'elettrone dell'idrogeno tende ad orbitare prevalentemente attorno al non metallo, pur non staccandosi completamente dal nucleo di idrogeno. Questo fenomeno ╚ tanto piś spiccato quanto piś il non metallo ha la tendenza ad accaparrarsi l'elettrone: questa tendenza si chiama elettronegativitř ed ╦ tanto forte quanto piś il non metallo si trova in alto a destra nella tabella degli elementi. Forte elettronegativitř hanno dunque F, CI e O.
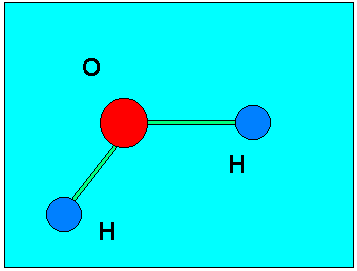
Questo fa in modo che la molecola abbia una polaritř, cio╦ sia caricata negativamente da un lato e positivamente dall'altro, comportandosi cos¤ come un piccolo magnete. La molecola piś diffusa che ha questo tipo di legame e comportamento ╦ l'acqua (H20), anche per un motivo che i due atomi di idrogeno sono disposti con un angolo di 108â tra di loro rispetto all'ossigeno. Vedremo poi cosa ci┌ comporta.
Questo legame dř infine un'altra possibilitř di legame tra due molecole differenti, che ╦ detto ponte di idrogeno. In pratica l'atomo di idrogeno, quale polo positivo, si mette a cavallo tra due non metalli, polarizzati negativamente. Questo tipico legame tra molecole ╦ tipico della doppia elica del DNA e mantiene l'ordine tra le basi azotate che formano il codice genetico.
5. Aciditř, basicitř, pH
Molte sostanze chimiche in cui il legame sia polare o ionico hanno la facoltř in soluzione acquosa di liberare un certo quantitativo di ioni H+ oppure OH-. Queste sostanze si dicono acidi nel primo caso o basi nel secondo. L'acqua stessa si pu┌ scindere in questi due ioni in una percentuale piccolissima: 10-7, cio╦ una molecola su 10 milioni. La proporzione di ioni H+ contenuti in una soluzione viene espressa con una grandezza chiamata pH, che corrisponde all'esponente della percentuale di ioni togliendo il segno negativo.
Nell'acqua pura quindi il pH ╦ 7, che indica un pH neutro. Un pH sotto il 7 ╦ quindi acido (molti ioni H+ in soluizione) mentre un pH piś alto di 7 ╦ basico. Il pH pu┌ quindi andare da un minimo di 0 (acidissimo) ad un massimo di 14 (estremamente basico).
Un acido forte ╦ un acido che in soluzione si divide in grande proporzione in ioni, liberando cos¤ una forte quantitř di ioni H+ e portando la soluzione ad un pH molto basso: un esempio sono l'acido cloridrico o quello solforico, che si dissociano completamente. Lo stesso discorso si fa anche per le basi, di cui quelle forti liberano una grande quantitř di ioni OH- portando il pH della soluzione verso il 14.
Un acido debole o una base debole sono invece quei composti che in soluzione si dissociano solo poco (in minima parte) per cui il pH non arriva molto in basso o molto in alto. L'acido acetico o l'acido carbonico sono acidi deboli. Gli acidi nucleici, presenti nel DNA sono pure acidi molto deboli.
6. L'acqua
La sostanza piś importante per la vita, sotto tutti i punti di vista, ╦ l'acqua. Essa ╦ formata da due atomi di idrogeno combinati con uno di ossigeno: H20.
Come giř detto la posizione dei due atomi di idrogeno forma un angolo di 108â e questo dř alla molecola d'acqua una caratteristica polare. Proprio per questa sua caratteristica polare l'acqua ha proprietř che sono del tutto peculiari per una sostanza del suo genere: infatti essa bolle ad una temperatura molto superiore a quella dei liquidi simili e congela pure ad una temperatura superiore aumentando il suo volume allo stato solido (al contrario di tutte le altre sostanze). Insomma le caratteristiche fisiche dell'acqua (congelamento a 0âC, ebollizione a 100âC, ghiaccio meno denso dell'acqua e quindi galleggiante su di essa, grande capacitř di assorbire calore, ecc.) sono dovute proprie a queste sue particolaritř di legami molecolari. E tutte queste caratteristiche dell'acqua hanno permesso la formazione della vita sulla Terra.
Nel nostro corpo l'acqua forma il 65-70% della massa. In essa avvengono tutte le reazioni chimiche che permettono la vita. Tutti i processi chimici vitali infatti devono e possono avvenire soltanto in soluzione. Per questo un adeguato quantitativo di acqua ╦ indispensabile per la vita. La perdita di un 10-15% dell'acqua del porta alla morte per disidratazione.
7. Composizione di materia vivente
Gli elementi che costituiscono il 96% della materia vivente sono C, O, H, N (carbonio, ossigeno, idrogeno, e azoto) e sono parte degli 11 elementi principali che costituiscono il corpo umano. Altri 15 elementi sono presenti in tracce.
Nathalie Steib, Bianca Buser fecerunt
8. Allegati

dir Uni Trieste
8.1 Tavole di Martini fondamenti 2
Sommario visuale: anatomia umana per studenti
Fonti: Martini & Timmons, Edises 2003
Universitř di Trieste
Cliccando su un immagine, si vede una versione leggibile. Per stampare il file, conviene di caricarlo sul proprio ordinatore (cliccando su .pdf). Per lo studio ╦ indispensabile il testo integrale (vedi Bibliografia).
8.2 Bibliografia
- Libri di riferimento
: - * ANATOMIA & FISIOLOGIA di Gary A. Thibodeau e Kevin T. Patton, CASA EDITRICE AMBROSIANA, ISBN 88-408-0977-5
* come approfondimento: Martini F. M. & Timmons M. S.:Anatomia umana. Con CD-ROM; Edises 2 ed., 886 p., ill., 2003; ? 98,00
* come introduzione: Monfroni L.; Pavanati Bettoni C. Elementi di biologia attiva, Casa Editrice Signorelli - Milano
8.3 Pagine correlate, Sitografia
- Nozioni di biochimica Lucidi
MmP 7.5 - Basi chimiche Dispensa
AF 1.2 - Biochimica Istituto Galileo Galilei
- Categoria:Biochimica it.Wikipedia
- Biochimica it. Wikipedia
8.4 Pagine in gruppo CSA
CSA / Anatomia & Fisiologia | Apparato circolatorio | Apparato digerente | Apparato digerente | Apparato locomotore | Apparato respiratorio | Apparato riproduttivo | Basi chimiche della vita | Concetti generali anatomici e fisiologici | Dermatopatologia | Farmacologia | I tessuti | Igiene | Immagini articolazioni | Immagini muscoli e muscolatura | Immagini scheletro e ossa | La cellula | La pelle | Legislazione sanitaria | Lesioni e traumi del apparato muscoloscheletrico | Malattie del sistema digerente | Malattie del sistema endocrino e ormonale | Malattie del sistema muscoloscheletrico (locomotore) | Malattie del sistema nervoso e del cervello | Malattie del sistema respiratorio | Malattie del sistema urinario | Malattie di articolazioni e tessuti molli | Malattie dismetaboliche | Malattie ossee | Organi di senso | Patologia | Patologia del sistema circolatorio e del sangue | Pronto soccorso | Sistema escretore | Sistema linfatico | Sistema linfatico | Sistema nervoso | Sistema ormonale | Anamnesi e Diagnostica | Batteriologia | Corso di studio assistito CSA | Group Attributes | Group Footer | Group Header | Group Print Footer | Group Print Header | Infiammazioni | Introduzione allo studio delle malattie infettive | Malattie del cuore | Malattie del fegato, biliari e pancres | Malattie del sangue | Malattie del sistema gastrointestinale | Malattie infettive batteriche | Malattie infettive parassitarie | Malattie infettive virali e da prioni | Micosi (malattie infettive fungine) | Modelli di psicologia e psicosomatica | Mutazioni cellulari | Neoplasmi | Patologia Circolatoria | Patologia generale | Patologia Speciale | Psicologia e Psicosomatica | Recent Changes |
Peter Forster fecit
8.5 Commenti, links
Grazie dell'avviso. Capita, perch╚ il programma si deve raccogliere gli immagini dei siti originali. E ogni tanto anche loro non funzionano. Uno ╦ chiuso e ho sostituito l'immagine (acido / base). Il sito per l"atomo" invece aveva solo un disturbo passeggero.
A proposito, puoi vedere i siti originali e le loro descrizioni, semplicemente cliccando sull'immagine. Se non c'╦ piś un immagine: in <Edit Section> trovi l'indirizzo URL del sito originale e dell'immagine. Quello del sito ha al solito il suffisso .html
L'ho organizzato in questo modo, perch╚ dovendo scaricare tutti gli immagini illustrativi sul mio sito, costerebbe una enormitř di memoria e quindi anche di soldi.
Saluti. 8>)__Peter August 11, 2007, at 12:23 PM
Scriva il Suo Commento => Firmi in Autore => Post:
Dopo pochi secondo appare il Suo commento in rete, visibile per tutti
| ę Cc by Autori |
Medicina popolare | Squadra galenica | Enciclopedia | Immagini | Lavoro corporeo | Novitř | Casistica | Redazione | Abstracts
| 9 ospiti attualmente in linea su Redazione online |
|